Humira ir pilnībā humanizēta monoklonāla antiviela. Tas nozīmē, ka, lai arī tas tiek ražots cilvēka organismā, kas nav cilvēka organisms, faktiskā olbaltumvielu sastāvs ir identisks cilvēka antivielu sastāvam. Un tas nošķīra Humira no monoklonālo antivielu TNF blokatoru, kas tika apstiprināts pirms tā – tā olbaltumvielu sastāvs daļēji tika iegūts no cilvēka (peles) antivielas.
2002. gadā Humira pirmo reizi apstiprināja ASV Pārtikas un zāļu pārvalde (FDA) kā ārstēšana reimatoīdā artrīta ārstēšanai. Tas ir viens no vairākiem bioloģiskajiem medikamentiem, kas bloķē TNF-alfa, tostarp: Enbrel (Etanercept): pirmā anti-TNF zāle, ko 1998. gadā apstiprināja FDA par reimatoīdo artrītu un dažiem iekaisuma artrīta veidiem.
Remicade (infliksimabs): Otrais TNF inhibitors, kuru FDA apstiprina 1999. gadā.
Simponi (Golimumabs): apstiprināja FDA 2009. gada 24. aprīlī.
- Cimzia (Certolizumab Pegol): apstiprināja FDA 2009. gada 14. maijā.
- Deva
- Humira tiek ievadīts subkutāni (zem ādas) pašinjekcijas reizi divās nedēļās. Ārsts to var ieteikt pacientiem injicēt katru nedēļu, ja ik pēc 14 dienām nepietiek.
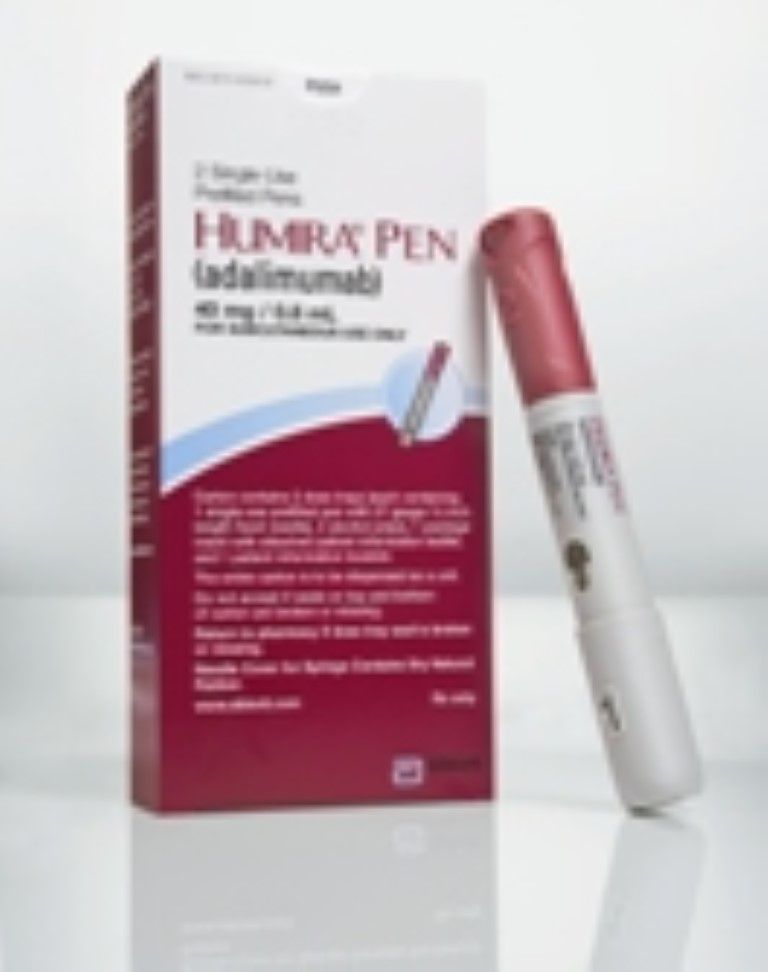
- Tas vispirms bija pieejams vienreizējas lietošanas pilnšļircē. Tika izveidota vienreizēja lietošanas vienreizējas lietošanas piegādes sistēma, kas pazīstama kā Humira pildspalva.
Ieteicamā deva ir 40 mg kā subkutāni injekcijas veidā, izmantojot pilnšļirci vai Humira pildspalvveida pilnšļirci katru otro nedēļu. Lietojot Humira, var turpināt lietot metotreksātu, citus nebioloģiskus DMARD, glikokortikoīdus, nesteroīdos pretiekaisuma līdzekļus (NPL) vai pretsāpju līdzekļus (sāpju zāles). Tomēr citus bioloģiskos DMARD nedrīkst lietot.
Indikācijas
Vairākas norādes ir pievienotas Humira, jo sākotnēji to apstiprināja FDA. To var nozīmēt arī, lai ārstētu:
reimatoīdo artrītu
ankilozējošo spondilītu
psoriātisko artrītu
- nepilngadīgo idiopātisko artrītu
- plakstiņu psoriāzi
- čūla kolītu
- pieaugušo un bērnu Krona slimību
- Hidradenitis Suppurativa
- blakusparādības
- Biežas blakusparādības, kas saistītas ar Humira, ir: viegla injekcijas vietā
- Izsitumi
Galvassāpes
Kuņģa darbības traucējumi vai slikta dūša
- Pneimonija
- Blakusparādības
- Tā kā tā nomāc imūno sistēmu organismā, kas parasti cīnās pret infekciju, Humira lietošana ir saistīta ar nopietnām infekcijām, piemēram, tuberkulozi, sepse un sēnīšu infekcijām . Tas var pastiprināt arī nervu sistēmas slimību simptomus (piemēram, demielinizējošos traucējumus). Klīniskajos pētījumos dažiem pacientiem 24 mēnešu laikā bija vēzis un limfoma.
- Kam nevajadzētu lietot Humira
- Humira nedrīkst lietot pacienti ar zināmu alerģiju pret šo zāļu vai tā sastāvdaļām. To nedrīkst lietot arī pacienti, kuri ir stāvoklī vai barojušies.
Zāles nedrīkst parakstīt pacientiem, kuriem ir aktīva infekcija, vai pacientiem, kuriem ir predispozīcija pret infekciju, tai skaitā pacientiem ar nekontrolētu cukura diabētu vai pacientiem, kuriem ir bijusi recidīva infekcija.
Pastāstiet ārstam
Ja Jums ir aktīva infekcija
Ja esat inficējies ar B hepatītu vai esat nesējviela (Humira lietošana ir saistīta ar B hepatīta reaktivāciju)
Ja Jums ir nejutīgums, tirings, vai multiplā skleroze vai centrālās nervu sistēmas traucējumi
Ja Jums ir bijusi ārstēta sirds mazspēja
- Pirms jebkuru vakcīnu vai ķirurģiskas iejaukšanās
- Lai ziņotu par iespējamām blakusparādībām, varat sazināties ar AbbVie Inc.at 1-800- 633-9110 vai FDA vietnē 1-800-FDA-1088 vai www.fda.gov/medwatch.

